aUnità di Oncologia Ginecologica, ARNAS “Civico – Di Cristina – Benfratelli”, Dipartimento di Promozione della Salute, Cura della Madre e del Bambino, Medicina Interna e Specialità Mediche (PROMISE), Università di Palermo, Palermo, Italia
bLaboratorio di Biologia dei Sistemi, Dipartimento di Medicina Sperimentale, Università Sapienza di Roma, Roma, Italia
cTerzo Dipartimento di Ostetricia e Ginecologia, Università Aristotele di Salonicco, Salonicco, Grecia
dLaboratorio di Fecondazione in Vitro (FIV), Centro di Fertilità IAKENTRO, Salonicco, Grecia
Introduzione
Proprietà degli inositoli
Supplementazione di DCI
Proprietà del DCI
Sindrome dell’ovaio policistico (PCOS)
Ovulazione
Endometriosi
Miomi uterini
Iperplasia endometriale
Tumori endometriali e al seno
Disturbi dell’umore
Sindrome da iperstimolazione ovarica (OHSS)
Il paradosso ovarico
Sicurezza
Conclusioni
Bibliografia
Il mondo dei composti naturali è stato studiato con l’obiettivo di scoprire possibili applicazioni terapetutiche fin dall’origine della medicina. Recentemente, il campo della ginecologia ha sviluppato un crescente interesse per gli inositoli [1]. Gli inositoli sono polioli ciclici con un ruolo chiave in molteplici vie metaboliche. La loro stabilità lungo l’evoluzione della vita può contrassegnare queste molecole come prebiotiche, data la loro importanza biochimica [2]. Queste molecole possono essere classificate in nove composti stereoisomerici; tra di essi, il mio-inositolo (MI) è la forma più importante e abbondante in natura [3]. Gli inositoli sono stati scoperti per la prima volta nel 1850 da Johanes Joseph Scherer ed estratti dalle cellule muscolari, il cui nome persiste ancora nel composto (myo= muscolo in greco). Negli esseri umani, gli inositoli derivano dalla dieta nella forma primaria di MI. Successivamente, il MI può essere convertito in diverse forme come il D-chiro-inositolo (DCI), grazie all’azione dell’insulina e con l’azione di una specifica epimerasi dipendente dalla nicotinamide adenina dinucleotide (NAD)-NADH [4]. L’obiettivo principale di questo capitolo è esaminare e discutere le proprietà biochimiche del DCI e le sue implicazioni cliniche. In particolare, fornirà dettagli sulle possibili applicazioni cliniche della supplementazione di DCI nelle donne, considerando gli effetti biochimici principali.
Biochimica
Gli inositoli sono normalmente presenti all’interno delle cellule nella loro forma libera o nella membrana plasmatica come fosfatidilinositoli [5]. Queste forme possono essere fosforilate in fosfatidilinositolo fosfato (PIP) e fosfatidilinositolo bisfosfato (PIP2). Sotto l’azione della fosfolipasi-C (PLP-C), il PIP2 dà vita a un mediatore intracellulare e un secondo messaggero, l’inositolo trifosfato (InsP3) [5]. Inoltre, sia il MI che il DCI possono agire come secondi messaggeri all’interno della cellula come fosfatoglicani di inositolo (IPG) nelle loro forme come MI-IPG e DCI-IPG. Entrambi mediano e sono coinvolti nella via di segnalazione dell’insulina, ma ci sono alcune differenze marcate [6]. La Figura 1 aiuta a visualizzare il percorso complesso.
Il pool intracellulare di inositolo nei tessuti è quasi esclusivamente (>99%) composto da MI. Tuttavia, il contenuto di MI e DCI è significativamente diverso nel grasso, nei muscoli e nel fegato, in base alle diverse funzioni degli isomeri [7]. La concentrazione di MI è più elevata nei tessuti ad alto consumo di glucosio, come il cervello e il cuore [6]. Infatti, il MI-IPG è strettamente legato al miglioramento dell’assorbimento cellulare del glucosio inducendo la traslocazione di GLUT4 nella membrana cellulare [8], riducendo l’enzima adenilato ciclasi e inibendo il catabolismo degli acidi grassi liberi dai tessuti adiposi. In questo caso, il MI è responsabile di un aumento della sensibilità all’insulina degli adipociti [6].
Al contrario, la concentrazione di DCI-IPG è maggiore nei tessuti dedicati all’accumulo di glicogeno (cioè fegato, muscoli e grasso) e inferiore nei tessuti con ad alto consumo di glucosio. In particolare, il DCI-IPG è il principale partecipante nella sintesi del glicogeno, inducendo la glicogeno sintasi e la piruvato deidrogenasi (PDH) [8,9].
Queste differenze sono rilevate valutando il rapporto MI/DCI nei tessuti. Infatti, i rapporti di MI e DCI sono stati studiati e si è scoperto che svolgono un ruolo significativo in diversi processi fisiologici [10]. L’epimerasi, che converte il MI in DCI, ha un’attività tessuto-specifica [7] ed è responsabile dei rapporti specifici di MI/DCI in diversi tessuti e organi [11]. In particolare, questo rapporto è di circa 40:1 nel sangue periferico [12], circa 20:1 nelle cellule della teca e nell’intervallo di 70:1–100:1 nel liquido follicolare dei follicoli dominanti [4]. Questi rapporti sottolineano e suggeriscono un ruolo specifico per gli inositoli, anche se non ancora chiaramente definito.
Considerando l’azione ormonale degli inositoli, sono emersi risultati diversi nel corso degli anni. Gli inositoli, e in particolare il MI, partecipano alla via di segnalazione dell’ormone follicolo-stimolante (FSH). L’FSH si lega al recettore dell’FSH (FSHR) e il MI è un secondo mediatore intracellulare che media la via di segnalazione che regola la proliferazione e la maturazione delle cellule della granulosa. Inoltre, MI e PLP-C mediano il rilascio di InsP3, che aumenta i livelli intracellulari di Ca2+ [13]. La Figura 2 aiuta a visualizzare il percorso complesso. Durante le fasi finali della maturazione dell’ovocita, la legatura di InsP3 al suo recettore 1 (IP3-R1), che rilascia ulteriormente il calcio, sembra svolgere un ruolo chiave nella promozione della progressione meiotica [14].
Inoltre, il MI-IPG è correlato alla regolazione del citoscheletro [15] e alla produzione indotta da FSH dell’ormone anti-Mülleriano (AMH), responsabile della sensibilità all’FSH nel follicolo [16].
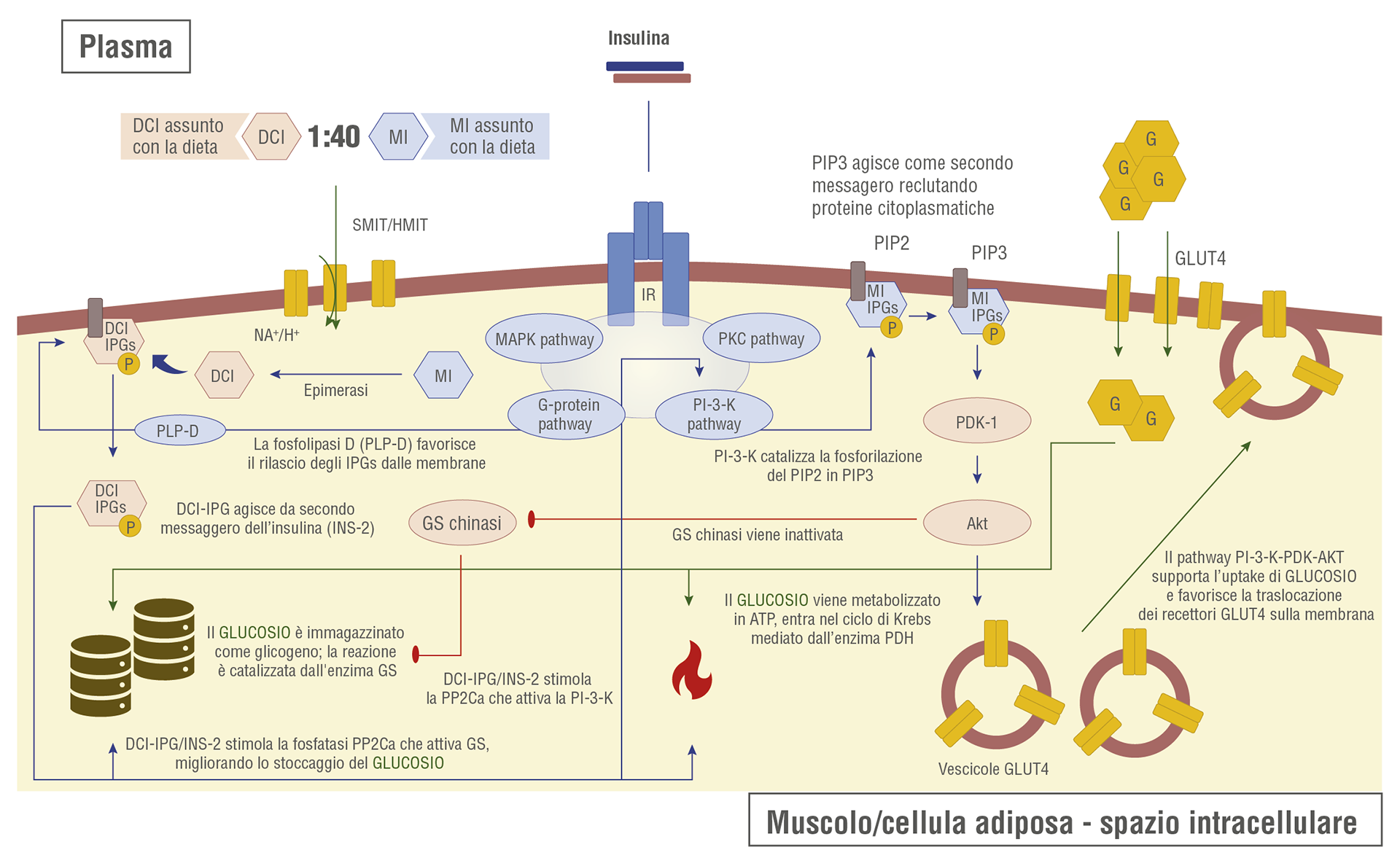
Fig. 1 Ruoli del myo-inositolo (MI) e del D-chiro-inositolo (DCI) nelle vie metaboliche cellulari regolate dall’insulina del glucosio. (Da Laganà AS, Garzon S, Casarin J, Franchi M, Ghezzi F. Inositol in polycystic ovary syndrome: restoring fertility through a pathophysiology-based approach. Trends Endocrinol Metab. 2018;29(11):768–80. hiips://doi.org/10.1016/j.tem.2018.09.001 .)
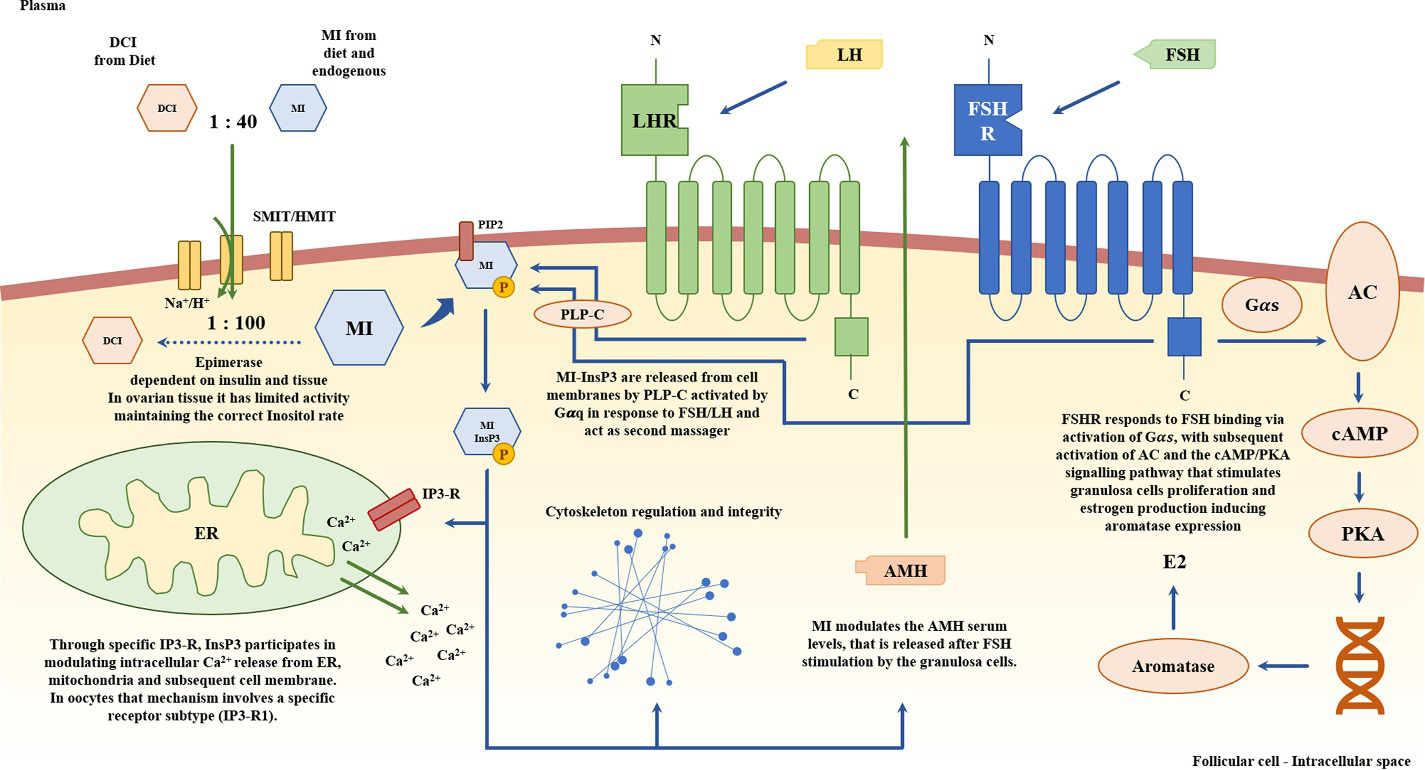
Al contrario, l’FSH attiva le vie del cAMP/PKA, che regolano positivamente l’aromatasi e, di conseguenza, la steroidogenesi.
È stato dimostrato che il DCI stimola direttamente la produzione di testosterone nelle cellule tecali umane [18]. Nella sua forma DCI-IPG, il DCI partecipa all’espressione dei geni che codificano enzimi steroidogenici nelle cellule della granulosa umane, riducendo l’espressione del mRNA sia dell’aromatasi (CYP19A1) [18] che del citocromo P450 side-chain cleavage (P450scc) in modo dose-dipendente [19]. Inoltre, il DCI aumenta i livelli di testosterone nelle cellule tecali delle donne affette da sindrome dell’ovaio policistico (PCOS). Ciò avviene perché agisce come un insulino-mimetico [18].
Il MI e il DCI condividono alcune proprietà chimiche, ma sembrano avere effetti piuttosto differenti sulle vie metaboliche. Ad esempio, il MI sembra avere un effetto positivo sull’espressione dell’aromatasi, mentre è stato dimostrato che il DCI la inibisce. Per quanto riguarda l’azione del MI sull’aromatasi, esiste un’ipotesi generalmente accettata riguardo al ruolo del secondo messaggero InsP3, noto per indurre l’attività dell’aromatasi nelle cellule della granulosa [20]. Tuttavia, questa opinione è attualmente una tendenza e non è derivata dai dati. In particolare, potrebbe essere utile considerare l’azione di MI e DCI come un feedback quantitativo sull’aromatasi, dove il rapporto MI/DCI potrebbe essere responsabile dell’effetto finale. In particolare, un rapporto MI/DCI più elevato dovrebbe avere un’influenza positiva sull’attività dell’aromatasi nelle cellule della granulosa, aumentando la biosintesi degli estrogeni. Al contrario, un rapporto MI/DCI più basso dovrebbe ridurre i livelli di estrogeni e aumentare la produzione di androgeni nelle cellule della teca [21].
Proprietà del DCI
Il DCI ha una nota attività steroidogenica che può essere distinta in:
1. un effetto indiretto mediato dall’insulina;
2. un effetto diretto indipendente sulla steroidogenesi attraverso la riduzione dell’espressione genica dell’aromatasi e dei geni del citocromo P450 side-chain cleavage (P450scc).
Gli studi riguardanti la supplementazione di DCI sono principalmente legati alla convalida clinica degli effetti nelle donne con la sindrome dell’ovaio policistico (PCOS). Spesso presentano resistenza all’insulina e, dopo il trattamento, la sua riduzione. In particolare, il DCI agisce nei seguenti modi. In primo luogo, il DCI è responsabile di una diminuzione degli androgeni nel breve termine accompagnata da una diminuzione degli estrogeni [22]. In secondo luogo, il DCI agisce su aromatasi e sulla sintesi del testosterone. Ciò provoca un aumento dei livelli di androgeni [23]. Il DCI, quando somministrato a dosi più elevate, può quindi agire nel breve periodo aumentando i livelli di androgeni [24]. Considerando gli studi precedenti [25], sembra logico proporre la supplementazione di DCI in tutte le condizioni in cui una diminuzione dell’estradiolo e un aumento del testosterone sono considerati utili.
La sindrome dell’ovaio policistico (PCOS) è una sindrome clinica caratterizzata da anovulazione cronica e iperandrogenismo, che può colpire fino al 10% delle donne in età riproduttiva. L’eziopatogenesi è eterogenea e non ancora completamente chiarita [26–28]. La classificazione della PCOS è stata ampiamente studiata e i criteri di Rotterdam sono i più appropriati per una corretta diagnosi. I criteri di Rotterdam sono stati proposti nel 2003 dalla European Society of Human Reproduction and Embryology/American Society for Reproductive Medicine (ESHRE/ASRM) [29] e considerano almeno due dei tre criteri tra:
(1) iperandrogenismo clinico o biochimico;
(2) irregolarità mestruale;
(3) ovaie policistiche caratterizzate dalla rilevazione ecografica di 12 o più follicoli <9 mm di diametro e/o aumento del volume ovarico >10 ml e nell’assenza di un follicolo dominante.
Attualmente, MI e DCI sono oggetto di studio per il trattamento delle donne con PCOS, a causa della loro azione sensibilizzante all’insulina. L’idea di integrare gli inositoli nelle donne con PCOS deriva da due considerazioni:
(1) le proprietà riportate degli inositoli;
(2) la necessità di ridurre la quantità di metformina.
Da questi due punti, è cresciuto un grande interesse nella letteratura scientifica con un’enfasi sulla reale efficacia degli inositoli nelle donne con PCOS.
La PCOS è generalmente caratterizzata da resistenza all’insulina, la cui caratteristica è una ridotta conversione di MI a DCI [30,31]. Tuttavia, le ovaie non sviluppano insulino-resistenza come gli altri tessuti e, quindi, rispondono a elevati livelli di insulina [32]. Questa condizione compromette il corretto e fisiologico rapporto tra strato granulosa e strato teca, causando un aumento dello spessore della teca rispetto alla granulosa [33]. L’iperinsulinemia potenzia la via di segnalazione dell’LH sulle cellule tecali, che porta ad un aumento di testosterone e, successivamente, di estrogeni. Inoltre, nelle ovaie, lo stato di iperinsulinemia potenzia la conversione di MI a DCI nelle cellule della teca e riduce il rapporto MI/DCI, grazie alla iperstimolazione dell’attività dell’epimerasi [4].
In sintesi, nelle donne con PCOS si verifica un rapporto MI/DCI alterato con un valore diminuito. Al contrario, nelle donne sane, il MI è presente in quantità maggiori. Questi dati provengono da studi che valutano il rapporto MI/DCI nelle cellule della teca [4] e nel liquido follicolare [34] di donne sane e donne con PCOS.
Per questo motivo, sembra piuttosto ragionevole e logico proporre un trattamento adeguato e personalizzato con MI e DCI per le donne con PCOS. Dovrebbe essere prestata particolare attenzione al timing del trattamento. Infatti, l’effetto positivo del DCI è stato dimostrato essere efficace nel breve termine. Tuttavia, nel lungo termine, il DCI potrebbe ridurre l’azione dell’aromatasi e potenzialmente aumentare i livelli di testosterone, peggiorando così la condizione di PCOS.
Circa 20 anni fa, è stato osservato che nelle donne con PCOS obese, un supplemento di DCI di 1200 mg al giorno riduceva significativamente il livello di testosterone plasmatico e migliorava l’ovulazione. Inoltre, migliorava il metabolismo, riducendo sia la pressione sanguigna che i trigliceridi [5]. Successivamente, uno studio aumentò il dosaggio di DCI a 2400 mg al giorno. Sorprendentemente, i risultati precedenti non furono confermati e i livelli di testosterone non diminuirono [24].
Tuttavia, per quanto riguarda le forme stereoisomeriche degli inositoli, gli studi hanno cercato di trovare il corretto rapporto MI/DCI. La sola supplementazione di DCI non è sufficiente per le donne con PCOS. Infatti, dosi elevate di DCI sono state considerate dannose per le ovaie e la maturazione degli ovociti [35]. Inoltre, il DCI non viene convertito in MI, risultando in una riduzione dell’attività specifica di MI. Successivamente, la perdita di MI e della sua forma intracellulare è correlata alla resistenza all’insulina.
Facchinetti et al. [36] hanno eseguito una meta-analisi confrontando l’effetto a breve termine di MI e metformina nell’alleviare i sintomi della PCOS. In particolare, nelle donne con PCOS non è stata riscontrata alcuna differenza tra MI e metformina in termini di insulina a digiuno, indice di valutazione del modello di omeostasi (HOMA), testosterone, androstenedione e globulina legante gli ormoni sessuali (SHBG). Al contrario, il MI era associato a un rischio inferiore di eventi avversi rispetto alla metformina. Per questo motivo, sembra abbastanza ragionevole utilizzare il MI al fine di ridurre il dosaggio terapeutico della metformina o migliorarne l’effetto sulla sensibilizzazione all’insulina [36].
Nordio et al. hanno per la prima volta descritto i risultati confrontando la somministrazione di diversi rapporti MI/DCI (0:1; 1:3,5; 2,5:1; 5:1; 20:1; 40:1 e 80:1) nelle donne con PCOS. L’outcome principalmente studiato è stato quello inerente all’ovulazione, rilevando le medie dei livelli di progesterone. Gli outcome secondari riguardavano parametri metabolici come FSH, LH, SHBG, E2, testosterone libero, indice HOMA e insulina basale e postprandiale. Il miglior rapporto testato è risultato essere il rapporto 40:1, seguito da 20:1 e 80:1. Al contrario, le altre combinazioni non hanno mostrato risultati significativi [37].
In particolare, le prove suggeriscono un rapporto combinato di 40:1 con benefici di successo in termini di miglioramento del fenotipo e della fertilità [38]. Una recente meta-analisi [39] ha preso in considerazione 9 RCT sulla supplementazione di MI da sola o in associazione con DCI nel rapporto 40:1 nelle donne con PCOS. Gli autori hanno riportato che la supplementazione di inositolo riduceva significativamente l’insulina a digiuno e l’indice HOMA.
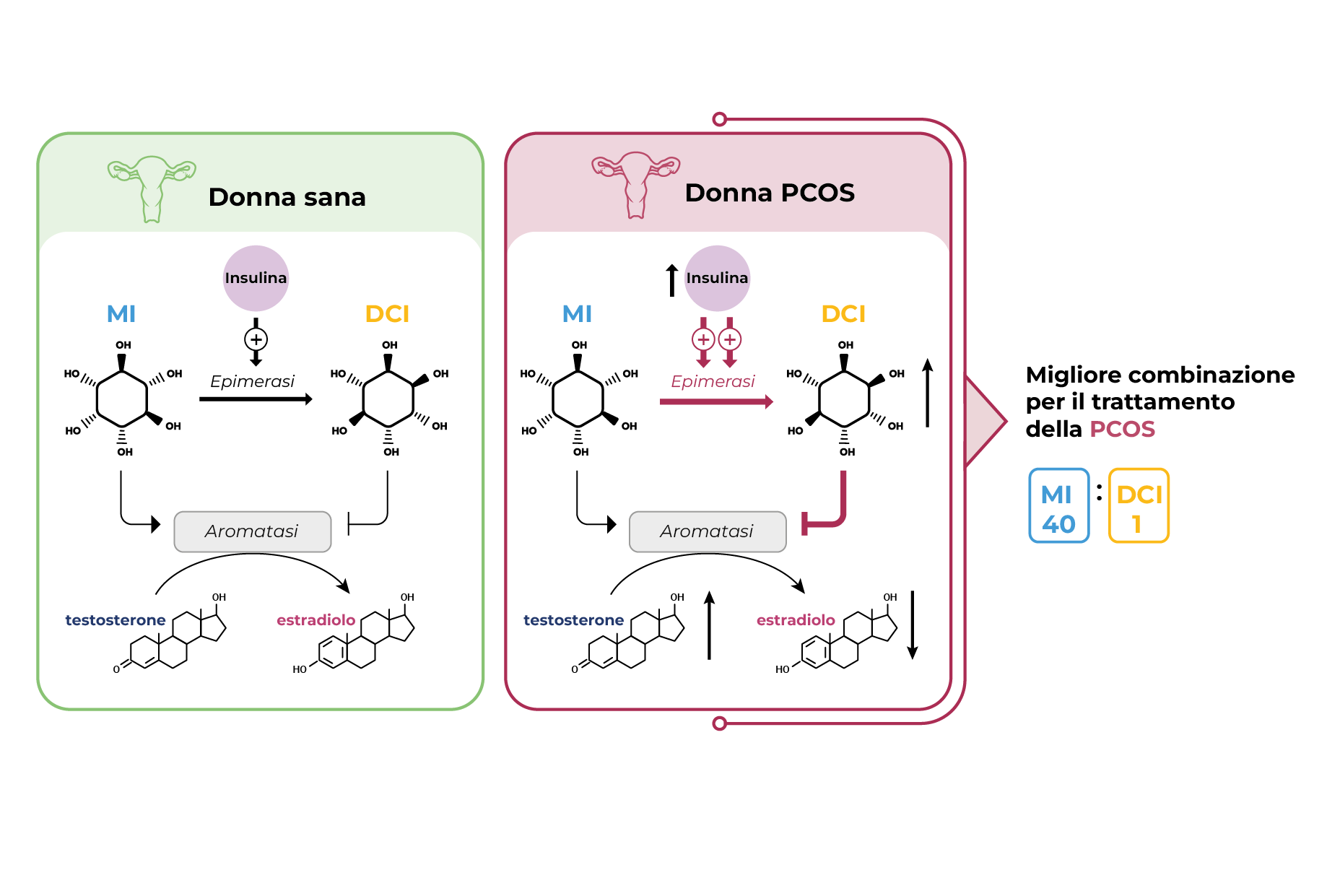
La Figura 3 mostra graficamente l’effetto dell’inositolo sulla biosintesi degli estrogeni nelle cellule della granulosa. Nelle donne con PCOS, un aumento dell’attività dell’epimerasi dovuto all’azione dell’insulina determina una maggiore trasformazione da MI a DCI. L’aumento di DCI esercita il suo effetto nella soppressione dell’aromatasi e della sua attività. Di conseguenza, una quantità inferiore di testosterone viene convertita in estradiolo. In conclusione, il percorso metabolico della PCOS porta a un aumento dei livelli di androgeni e a una diminuzione dei livelli di estrogeni. Ragionevolmente, una conversione dal MI al DCI richiede la supplementazione di MI per bilanciare l’equilibrio stereoisomerico degli inositoli.
L’anovulazione è una condizione che influisce sulla fertilità e rappresenta una significativa fetta di tutte le cause di infertilità. In queste pazienti, si verificano cicli mestruali senza ovulazione. Inoltre, cicli anovulatori continui possono avere un impatto sul metabolismo osseo. In particolare, è stato dimostrato che i cicli anovulatori aumentano il riassorbimento osseo. Al contrario, i cicli ovulatori riducono il riassorbimento osseo durante la fase luteale e il ciclo successivo [40].
L’anovulazione è stata classificata dal Gruppo di lavoro Capri dell’ESHRE [41] come segue:
(1) Insufficienza ovarica primaria: una condizione in cui è assente o fortemente ridotto il pool di ovociti primordiali. È caratterizzata da amenorrea e livelli sierici elevati di FSH e LH.
(2) Insufficienza ovarica secondaria: una condizione caratterizzata dalla mancanza di adeguata stimolazione gonadotropica delle ovaie. Può quindi essere distinta in:
a. Ipopituitarismo ipogonadotropo (gruppo 1 dell’OMS). In questo caso, si verifica l’ano-ovulazione poiché i livelli di LH e FSH sono al di sotto della soglia necessaria per stimolare lo sviluppo del follicolo antrale. Successivamente, i livelli di estrogeni risultano bassi.
b. Anovulazione normogonadotropa (gruppo 2 dell’OMS). In questo scenario, si verifica l’ano-ovulazione, ma i livelli di gonadotropine sono normali. Diverse eziologie possono causare questa condizione, ma il 91% dei casi riguarda esclusivamente le donne con PCOS. Infatti, la PCOS è il disturbo endocrino più comune nelle donne ed è la principale causa di ano-ovulazione [42].
Nelle donne anovulatorie del gruppo 2 dell’OMS, l’obiettivo ideale di un trattamento è indurre l’ovulazione. Tuttavia, prima di stimolare l’ovulazione stessa con gonadotropina corionica umana (hCG), è necessaria una terapia appropriata che ripristini l’asse ipotalamo-ipofisi-ovaio. Sono necessari agenti orali che riducano la biosintesi degli estrogeni e, di conseguenza, diminuiscano il feedback ipotalamico negativo sull’ormone di rilascio delle gonadotropine (GnRH) e sull’ormone follicolo-stimolante (FSH) [43]. Anche se possono essere utilizzati modulatori selettivi dei recettori degli estrogeni, come il clomifene citrato (CC), o inibitori dell’aromatasi di terza generazione, come letrozolo o anastrozolo, recentemente il DCI è stato scoperto avere un ruolo importante in tale contesto. Infatti, il DCI ha un effetto dose-dipendente nell’indurre l’ovulazione. In particolare, nelle donne con PCOS, è stato riscontrato che un dosaggio di DCI fino a 1200 mg al giorno per 6-8 settimane era adeguato per indurre l’ovulazione nel 44% delle pazienti rispetto al gruppo di controllo [44]. Inoltre, questo effetto era indipendente dall’indice di massa corporea (BMI) delle pazienti [45]. Allo stesso modo, Bezzerra Espinola et al. hanno recentemente presentato un caso clinico indicando che un trattamento di 6 settimane con 1200 mg al giorno di DCI è in grado di indurre ovulazione nelle donne magre non affette da PCOS. L’ovulazione è stata indicata da un aumento del progesterone da 0,5 a 12 ng/mL [46,47]. L’induzione dell’ovulazione può essere ottenuta attraverso due meccanismi differenti:
(1) con la diminuita attività dell’aromatasi, che riduce il livello di estrogeni. Questo risultato ripristina il normale feedback dell’asse ipotalamo-ipofisi-ovaio, consentendo la secrezione di FSH e il successivo reclutamento di follicoli antrali.
(2) con livelli più bassi di insulina, che sembrano agire in modo duplice. In primo luogo, si riduce la biosintesi di androgeni stimolata dall’insulina. In secondo luogo, si ostacola l’attività dell’aromatasi dipendente dall’insulina.
Per questo motivo, sembra comprensibile utilizzare una combinazione di DCI con metformina. In particolare, l’effetto finale può essere sia una partecipazione diretta del DCI nella riduzione dei livelli di estrogeni sia un effetto indiretto nella riduzione del dosaggio di metformina e, di conseguenza, dei possibili effetti collaterali [48]. Tuttavia, a causa dell’effetto dell’aumento degli androgeni causate dal DCI, dovrebbero essere evitate integrazioni a lungo termine con dosaggi elevati. In particolare, dosaggi elevati potrebbero avere un impatto negativo potenziale sull’ovaio, come spiegato successivamente nella sezione “Il paradosso ovarico”. Infatti, i dati di Bevilacqua et al. suggeriscono che dosaggi elevati di DCI inducono un fenotipo simile alla PCOS nei modelli murini. Questo fenotipo è caratterizzato da follicoli terziari cistici con ovociti atresici o privi di ovociti [47,49].
L’endometriosi è una patologia ginecologica frequente che influisce sulla qualità di vita e sulla fertilità delle donne ed è nota per colpire circa il 10% delle donne in età riproduttiva [50]. Si verifica principalmente durante l’età riproduttiva e tende ad attenuarsi con la menopausa, quando la produzione di estrogeni diminuisce. L’endometriosi è caratterizzata dalla crescita di tessuto endometriale al di fuori della cavità uterina. In generale, circa il 25% delle donne colpite non presenta sintomi. Tuttavia, nella maggior parte dei casi, le donne soffrono di dismenorrea, menorragia, dolore pelvico e affaticamento cronico [50]. Inoltre, come precedentemente indicato, l’endometriosi spesso compromette l’infertilità, portando a una possibilità di concepimento ridotta di 10 volte rispetto a una coppia normalmente fertile. Riguardo all’istopatologia del tessuto endometriosico, scoperte recenti ci consentono di individuare un possibile bersaglio terapeutico del DCI.
In particolare, è stato dimostrato che i tessuti endometriali responsabili della patologia dell’endometriosi esprimono elevati livelli di aromatasi [51]. Questo enzima causa l’incremento della stimolazione degli estrogeni e il mantenimento di un ambiente pro-infiammatorio [52]. In particolare, la produzione di estrogeni dell’endometrio fa sì che la patologia si autoalimenti. L’approccio terapeutico classico consiste nella riduzione dei livelli di estrogeni, che ostacola la crescita dell’endometrio e riduce la sintomatologia. Per questo motivo, gli approcci terapeutici mirati a ridurre il livello di estrogeni includono il letrozolo e l’anastrozolo, e riducono significativamente il dolore pelvico, le dimensioni delle lesioni e il volume dell’endometrioma [53]. Ugualmente sono stati studiati i trattamenti con effetto insulino-sensibilizzante dimostrando la loro efficacia. La metformina, ad esempio, riduce la risposta infiammatoria, inibisce l’attività dell’aromatasi e consente la regressione dell’endometrioma [54]. Qui si trova la logica per l’integrazione di DCI. Dato il suo ruolo nell’inibire l’aromatasi, soprattutto in dosi elevate o a lungo termine, sembra avere un ruolo logico e potenziale nella riduzione dell’ambiente estrogenico e nel sollievo dalla sintomatologia dell’endometriosi. Inoltre, l’integrazione di DCI potrebbe svolgere un ruolo chiave nella riduzione degli effetti collaterali delle terapie sopra menzionate associandola a un approccio multifarmacologico.
I miomi uterini, chiamati anche fibromi o leiomiomi, sono tumori benigni comuni che crescono dalle cellule muscolari lisce dell’utero e colpiscono tra il 20% e il 30% delle donne in età fertile. Nella maggior parte dei casi, i miomi sono asintomatici e scompaiono spontaneamente dopo la menopausa [55]. Tuttavia, i miomi sintomatici sono noti per causare dolore pelvico, dismenorrea e metrorragia, compromettendo la qualità di vita delle donne. Studi precedenti sulle cellule dei miomi hanno riscontrato un’elevata espressione dell’enzima aromatasi rispetto al miometrio normale [56,57]. Di conseguenza, i livelli di estrogeni sono aumentati e i recettori del progesterone sono overespressi [58].
Attualmente, il trattamento standard d’oro per i miomi uterini sintomatici si basa su un approccio chirurgico [59,60]. Tuttavia, un approccio che si concentra sulla prevenzione delle complicanze legate alla chirurgia mira alla sintomatologia. In questo contesto, l’acetato di ulipristal (UPA), un modulatore selettivo dei recettori del progesterone (SPRM), è stato la terapia di prima linea per il trattamento dei miomi. L’effetto di questo farmaco era di silenziare la segnalazione del progesterone e quindi ridurre la crescita del mioma [61]. Tuttavia, poiché sono stati registrati gravi effetti avversi, tra cui insufficienza epatica, l’UPA è stato ritirato dal mercato [62]. Studi paralleli si sono concentrati sulla riduzione dei livelli di estrogeni [63]. In particolare, è stato dimostrato che un ambiente ipoestrogenico riduce la proliferazione delle cellule dei miomi uterini [64] e ne riduce le dimensioni nelle donne in postmenopausa [65]. Il trattamento medico con letrozolo, un inibitore dell’aromatasi, si è rivelato più efficiente rispetto alla terapia ormonale nel ridurre il volume del mioma. Questo ha recentemente suscitato un interesse crescente nel proporre l’uso di DCI per i miomi uterini [66]. In primo luogo, il DCI è una molecola naturale, e ci si aspetta che gli effetti collaterali siano inferiori rispetto ai farmaci precedentemente somministrati. In secondo luogo, le proprietà precedentemente citate del DCI possono essere efficaci e riassunti in due modi:
(1) il DCI induce la downregulation dell’aromatasi, riducendo i livelli di estrogeni;
(2) il DCI può modulare negativamente l’espressione dell’aromatasi direttamente nelle cellule muscolari lisce, riducendo la produzione di estrogeni in loco e rallentando la crescita dei tumori. Per queste proprietà conosciute, il DCI potrebbe ridurre l’ambiente estrogenico che a sua volta stimola la crescita dei miomi uterini. In secondo luogo, può alleviare segni e sintomi che influiscono negativamente sulla qualità della vita delle donne. Presi insieme, questi possibili effetti indicano che il DCI può anche essere una terapia adiuvante potenziale prima dell’intervento per i miomi e può quindi ridurre la possibilità di complicazioni legate alla chirurgia. Tuttavia, sono necessari studi clinici randomizzati ben progettati prima di trarre conclusioni definitive. In particolare, dovrebbero essere eseguiti protocolli che studino il dosaggio e la frequenza di somministrazione del DCI.
L’iperplasia endometriale è una condizione caratterizzata da un aumento della proliferazione cellulare endometriale, che può potenzialmente portare al carcinoma endometriale. L’iperplasia endometriale si può manifestare in due forme: tipica e atipica, con quest’ultima che mostra alterazioni più significative, tra cui atipia e nuclei sovrannumerari.
Vengono menzionati diversi fattori di rischio per l’iperplasia endometriale, come l’età, la nulliparità, l’alto indice di massa corporea, i cicli anovulatori e i livelli elevati di estrogeni. Gli estrogeni, in particolare l’estradiolo, vengono evidenziati come cruciali nel provocare la proliferazione endometriale. L’espressione dell’aromatasi P450 è aumentata nelle cellule di iperplasia endometriale nelle donne con sindrome dell’ovaio policistico (PCOS), portando a un aumento locale dei livelli di estrogeni e a uno stimolo di crescita successivo. Gli inibitori dell’aromatasi come l’anastrozolo svolgono un ruolo nel ridurre lo stimolo locale degli estrogeni e nell’indurre un endometrio atrofico. Tuttavia, a causa dei potenziali effetti collaterali della somministrazione di letrozolo, si considera il D-chiro-inositolo (DCI), una molecola naturale che regola negativamente l’aromatasi e riduce i livelli di estrogeni. L’idea è che l’integrazione di DCI, in combinazione con terapie consolidate come il letrozolo, potrebbe essere un approccio efficiente ed efficace nel trattare l’iperplasia endometriale.
Vi è comunque necessità di ulteriori studi clinici randomizzati ben progettati (RCT) per esplorare ulteriormente i potenziali benefici del DCI nel trattamento dell’iperplasia endometriale. Si sottolinea l’importanza di confrontare l’integrazione di DCI con terapie consolidate piuttosto che somministrare DCI da solo in un gruppo di pazienti. In sintesi, si suggerisce che l’integrazione di DCI, eventualmente in combinazione con altre terapie, potrebbe essere una promettente via per trattare l’iperplasia endometriale, ma ulteriori ricerche, in particolare attraverso RCT, sono essenziali per stabilirne l’efficacia e la sicurezza nella pratica clinica.
I tumori al seno e all’endometrio hanno diversi fattori di rischio in comune. In particolare, la maggior parte dei tumori al seno e dei tumori endometriali di tipo 1 sovraesprime i recettori degli estrogeni. Di conseguenza, il rischio di entrambi i tipi di tumori è più elevato nelle donne con livelli sistemici elevati di estrogeni [72,73]. Inoltre, studi precedenti suggeriscono che l’insulina e i fattori di crescita simili all’insulina (IGF) possano svolgere un ruolo nella carcinogenesi endometriale, agendo in collaborazione con gli estrogeni [74]. Gli inibitori dell’aromatasi vengono utilizzati in questi tumori sensibili agli ormoni a causa del loro effetto negativo sulla produzione di estrogeni. Oltre a ciò, si è scoperto che sono efficaci nel ridurre la recidiva a lungo termine del tumore dipendente dagli estrogeni e il tasso di mortalità correlato [75].
Tuttavia, come citato in precedenza, il trattamento cronico con inibitori dell’aromatasi può portare a possibili effetti collaterali. In particolare, lo stato ipoestrogenico conseguente può influire sulla qualità della vita delle donne e sul riassorbimento osseo. Per questo motivo, l’integrazione di DCI può avere un ruolo chiave nell’implementare l’attività degli inibitori dell’aromatasi, regolando negativamente l’aromatasi. Probabilmente, come indicato in precedenza, per l’iperplasia endometriale, il DCI potrebbe agire principalmente come un supplemento alle terapie ormonali consolidate.
I disturbi d’ansia e depressivi sono i più comuni tra tutti i disturbi psichiatrici [76]. L’analisi epidemiologica mostra la loro diffusa prevalenza e una correlazione con le differenze di genere [77]. In particolare, il numero di donne colpite da disturbi dell’umore è più del doppio rispetto agli uomini [78]. Questa differenza di genere indica un possibile ruolo degli ormoni gonadici nell’eziologia dei disturbi d’ansia e depressivi. Infatti, studi precedenti hanno dimostrato che le donne sono più inclini a sperimentare disturbi dell’umore, ansia e depressione durante le fluttuazioni ormonali, come la pubertà, la menopausa, i periodi perimestruali e post-partum [79].
Per quanto riguarda il possibile ruolo ormonale nell’eziologia, è stata chiarita la relazione tra i livelli di testosterone e i disturbi dell’umore nei maschi con ipogonadismo [80]. Allo stesso modo, il testosterone svolge un ruolo chiave nel comportamento delle donne. In particolare, le sue concentrazioni sono state trovate essere più di 10 volte superiori a quelle degli estrogeni in alcune aree del cervello, come l’ipotalamo [81]. Per questo motivo, il trattamento con testosterone è stato considerato idoneo per ripristinare la libido normale nelle donne con bassi livelli di testosterone associati a un disturbo dell’umore e ridotta libido [82].
Studi precedenti hanno già dimostrato l’effetto benefico della supplementazione di testosterone. In particolare, in uno studio condotto più di 30 anni fa, le donne in menopausa in buona salute sono state trattate con testosterone combinato con estrogeni o solo estrogeni. Lo studio ha mostrato che le donne nel primo gruppo si sentivano meglio dal punto di vista dell’umore, più composte, euforiche ed energiche rispetto al gruppo che riceveva solo estrogeni. Inoltre, quest’ultimo gruppo mostrava livelli più alti di estradiolo circolante [83]. Inoltre, nelle donne in perimenopausa con disturbi dell’umore climaterici, la somministrazione di testosterone influenzava positivamente la loro qualità di vita [84,85].
Considerando questi dati e le proprietà conosciute del DCI, è possibile proporre la sua integrazione nelle donne affette da disturbi dell’umore. Infatti, la downregulation dell’aromatasi può aumentare i livelli di testosterone e ripristinare la qualità di vita e il benessere sessuale delle donne. Sono necessari ulteriori studi poiché finora non sono stati eseguiti protocolli di integrazione di DCI. Tuttavia, il profilo di sicurezza e le proprietà del DCI possono essere utilizzati come presupposti per l’uso del DCI come coadiuvante del testosterone o, eventualmente, come sostituto.
La sindrome da iperstimolazione ovarica (OHSS) è una grave complicazione iatrogena che si verifica durante la stimolazione ovarica controllata (COS) nei trattamenti riproduttivi assistiti (ART). Questa sindrome è caratterizzata da un aumento della permeabilità vascolare e dalla ritenzione di fluido extravascolare, che può avere un forte effetto negativo sulla salute delle donne. L’OHSS può manifestarsi con un ampio spettro di sintomi clinici, da lievi (con una prevalenza del 20%-33%), come dolore addominale, a gravi con complicazioni potenzialmente letali (con una prevalenza del 3%-8%). A livello globale, l’incidenza dell’OHSS è in declino. Una diminuzione stabile è stata riportata dopo il picco di incidenza negli anni ’90, con un’incidenza di OHSS grave dell’0,2%-1%. In quegli anni, durante la COS, l’obiettivo principale era ottenere un numero maggiore di ovociti [86,87]. Attualmente, uno studio retrospettivo ha descritto una diminuzione dell’incidenza dell’OHSS dal 3,6% nel 2005 all’1% nel 2009 [88].
La sindrome si origina da una risposta ovarica eccessiva alle gonadotropine utilizzate per la stimolazione follicolare, con conseguente crescita multifollicolare. In aggiunta a ciò, l’ormone gonadotropina corionica umana (hCG) innescò l’insorgenza dell’OHSS [89]. Il timing può dividere la sindrome in esordio precoce e tardivo, quest’ultimo sostenuto principalmente dall’hCG endogeno. Il fattore di crescita endoteliale vascolare (VEGF) è indicato come il principale effettore della sindrome, poiché aumenta la permeabilità dei vasi sanguigni ovarici, causando uno spostamento di fluidi dallo spazio intravascolare principalmente al peritoneo [90,91]. L’approccio medico iniziale dovrebbe essere la prevenzione, che richiede una valutazione dei fattori di rischio e un monitoraggio rigoroso dei marcatori clinici. Tra questi, livelli di estrogeni insolitamente elevati sono generalmente considerati campanelli d’allarme [92]. Inoltre, quando si sospetta l’OHSS, dovrebbe essere presa in considerazione l’idea di abbandonare il ciclo di stimolazione ovarica, anche se ciò potrebbe comportare un onere economico e psicologico per le donne [93]. Al contrario, le strategie volte a ridurre l’incidenza dell’OHSS includono il posticipare dell’iniezione di trigger ovulatorio con hCG fino a quando i livelli di estradiolo diminuiscono sotto una soglia di sicurezza [94].
Per quanto riguarda un possibile approccio terapeutico, la riduzione degli estrogeni può essere ottenuta con un trattamento a breve termine con letrozolo prima dell’amministrazione di hCG. Questa strategia è stata dimostrata ridurre significativamente l’incidenza di OHSS nelle donne ad alto rischio sottoposte a COS [95,96]. In modo intrigante, trattamenti a lungo termine di più di 30 giorni con metformina durante la COS hanno dimostrato di ridurre significativamente il rischio di OHSS [97]. Considerando tutti questi risultati, emerge un potenziale ruolo del DCI nella prevenzione dell’OHSS. In particolare, l’efficacia del DCI può derivare da:
(1) il suo effetto indiretto nella mediazione del percorso di segnalazione dell’insulina.
(2) la downregulation dell’aromatasi e, di conseguenza, dei livelli di estrogeni.
Questo composto naturale potrebbe essere utilizzato come trattamento aggiuntivo, specialmente nelle pazienti ad alto rischio. Per questo motivo, il suo ruolo dovrebbe essere chiarito con ulteriori studi con l’obiettivo di trovare una corretta indicazione per prevenire l’insorgenza dell’OHSS.
Il ruolo del DCI nella fisiologia ovarica è ancora oggetto di dibattito [98]. Come già indicato, il rapporto MI:DCI nel liquido follicolare è stato trovato essere 100:1 [4]. Questo risultato può suggerire in anticipo un ruolo dell’inositolo nelle ovaie che è principalmente svolto dal MI. Tuttavia, per trovare possibili implicazioni delle due forme stereoisomeriche, gli studi derivanti dal campo del trattamento riproduttivo assistito (ART) vengono in nostro aiuto. Nell’ART, sono state prodotte evidenze riguardo all’influenza degli ovociti sia del MI che del DCI. Infatti, le analisi del rapporto MI:DCI nel liquido follicolare delle coppie sottoposte a fecondazione in vitro (IVF) hanno rivelato che rapporti più bassi, corrispondenti a contenuti più elevati di DCI, definiscono blastocisti di scarsa qualità. Al contrario, il MI con contenuti più elevati caratterizza blastocisti di migliore qualità. Inoltre, la somministrazione di MI alle pazienti sottoposte a fecondazione in vitro (IVF) e iniezione intracitoplasmatica dello spermatozoo (ICSI) ha mostrato risultati promettenti, con un aumento della risposta ovarica in termini di numero di ovociti recuperati e migliore qualità degli stessi (con meno ovociti germinali e ovociti degenerati) [99-102]. Da questi dati, è stato coniato recentemente un nuovo termine, il “paradosso ovarico”. Questo termine spiega lo scisma esistente tra il ruolo positivo del DCI per scopi ginecologici e il suo effetto negativo sulle ovaie. Più chiaramente, in varie condizioni o patologie, il DCI ha un ruolo benefico come già indicato, ad esempio nell’endometriosi, nei fibromi uterini e nella gestione del tumore sensibile agli estrogeni, grazie al suo ruolo di inibizione dell’aromatasi. Tuttavia, l’attività ovarica è compromessa dal DCI, soprattutto in dosi elevate. Poiché i due stereoisomeri dell’inositolo mostrano azioni diverse e presentano risultati opposti, le evidenze attuali non supportano l’integrazione del DCI da solo al fine di aumentare la risposta ovarica nell’ART. Inoltre, questi dati possono essere una chiave importante nell’indirizzare le indicazioni per l’integrazione di DCI. Quando è richiesta un’inibizione dell’aromatasi, il DCI potrebbe esercitare il suo ruolo benefico. In altri casi, ad esempio nella sindrome dell’ovaio policistico (PCOS), dovrebbe essere prestata un’adeguata attenzione al rapporto MI:DCI al fine di limitare l’effetto negativo del DCI sulle ovaie. In particolare, si propone l’integrazione orale combinata di MI e DCI nel rapporto di 40:1 come trattamento appropriato per ripristinare la normale funzione ovarica nelle donne con PCOS e migliorare contemporaneamente lo stato metabolico.
Attualmente, non sono ancora stati condotti studi sul profilo di sicurezza del DCI. Tuttavia, i dati provenienti dagli studi possono suggerire un profilo di sicurezza per l’integrazione di DCI. In particolare, il DCI somministrato a 1,2 g al giorno non presenta effetti collaterali avversi rilevanti. Tuttavia, come già indicato, l’integrazione di DCI compromette il metabolismo degli steroidi e può indurre un aumento dei livelli di androgeni. Questa condizione può aggravare la sintomatologia della sindrome dell’ovaio policistico (PCOS) e dovrebbe essere presa in considerazione dalla classe medica. Inoltre, si dovrebbe prestare attenzione quando si considera il “paradosso ovarico” nella somministrazione di DCI.
In conclusione, il DCI è stato ampiamente studiato nella sua fisiopatologia ed è noto per regolare negativamente l’espressione genica dell’aromatasi. Questa proprietà può avere un effetto terapeutico positivo che si distingue sia nell’aumento degli androgeni che nella riduzione dei livelli di estrogeni. Per questo motivo, esiste un effetto positivo del DCI su diverse condizioni che influenzano la salute o la qualità della vita delle donne. In particolare, una soluzione chiave per indurre l’ovulazione può essere trovata nel DCI, data la sua funzione nell’aiutare il ripristino dell’asse FSH. Inoltre, grazie alla sua attività nella downregulation dell’aromatasi e quindi nella riduzione dei livelli di estrogeni, l’integrazione di DCI potrebbe essere utile in tutte le condizioni in cui sono indicati inibitori dell’aromatasi. In particolare, l’endometriosi, l’iperplasia endometriale, i tumori endometriali e al seno, i fibromi uterini e i disturbi dell’umore possono trarre beneficio dall’attività del DCI. Questo possibile effetto benefico potrebbe quindi contribuire a ridurre la quantità di farmaco che deve essere somministrato, specialmente nei protocolli terapeutici cronici. Sono necessari studi clinici randomizzati ben progettati per valutare questi obiettivi positivi. Inoltre, le proprietà naturali del DCI suggeriscono che ci si può aspettare un profilo sicuro e una bassa incidenza di effetti collaterali. Tuttavia, è necessario considerare il “paradosso ovarico”, un termine che riflette un’azione negativa del DCI nelle ovaie durante i trattamenti riproduttivi assistiti. In particolare, dosaggi elevati di integrazione di DCI possono compromettere l’attività ovarica, con conseguente riduzione degli ovociti recuperati e con una qualità inferiore dopo la stimolazione ovarica controllata. Ciò dovrebbe essere attentamente considerato quando si inizia una supplementazione di DCI.
[1] Unfer V, Facchinetti F. Editorial—update on inositol(s). Eur Rev Med Pharmacol Sci 2017;21(2 Suppl):1–3.
[2] Saiardi A. Has inositol played any role in the origin of life? Life (Basel) 2017;7(2):24. https://doi.org/10.3390/life7020024. 28587245. PMCID: PMC5492146.
[3] Thomas MP, et al. The “other” inositols and their phosphates: synthesis, biology, and medicine (withrecent advances in myo-inositol chemistry). Angew Chem Int Ed Eng 2016;55:1614–50.
[4] Heimark D, et al. Decreased myo-inositol to chiro-inositol (M/C) ratios and increased M/C epimerase activity in PCOS theca cells demonstrate increased insulin sensitivity compared to controls. Endocr J 2014;61:111–7.
[5] Nestler JE, et al. Ovulatory and metabolic effects of D-chiroinositol in the polycystic ovary syndrome. New Engl J Med 1999;340:1314–20.
[6] Nestler JE, Unfer V. Reflections on inositol(s) for PCOS therapy: steps toward success. Gynecol Endocrinol 2015;31:501–5.
[7] Sun TH, Heimark DB, Nguygen T, et al. Both myo-inositol to chiro-inositol epimerase activities and chiro-inositol to myo-inositol ratios are decreased in tissues of GK type 2 diabetic rats compared to Wistar controls. Biochem Biophys Res Commun 2002;293(3):1092–8.
[8] Unfer V, et al. Effects of inositol(s) in women with PCOS: a systematic review of randomized controlled trials. Int J Endocrinol 2016;2016:1849162.
[9] Larner J. D-chiro-inositol—its functional role in insulin action and its deficit in insulin resistance. Int J Exp Diabetes Res 2002;3:47–60.
[10] Unfer V, Forte G. Does inositol ratio orchestrate the fate of ovarian follicles? Med Hypotheses 2020;144:109983.
[11] Facchinetti F, Espinola MSB, Dewailly D, et al. Breakthroughs in the use of Inositols for assisted reproductive treatment (ART). Trends Endocrinol Metab 2020. https://doi.org/10.1016/j. tem.2020.04.003.
[12] Facchinetti F, Dante G, Neri I. The ratio of MI to DCI and its impact in the treatment of polycystic ovary syndrome: experimental and literature evidences. In: Genazzani A, Tarlatzis B, editors. Frontiers in gynecological endocrinology. ISGE series. Cham: Springer; 2016. p. 103–9.
[13] Matsuda M, et al. Involvement of phospholipase C-related inactive protein in the mouse reproductive system through the regulation of gonadotropin levels. Biol Reprod 2009;81:681–9.
[14] Goud PT, et al. Presence and dynamic redistribution of type I inositol 1,4,5-trisphosphate receptors in human oocytes and embryos during in-vitro maturation, fertilization and early cleavage divisions. Mol Hum Reprod 1999;5:441–51.
[15] Bizzarri M, et al. Does myo-inositol effect on PCOS follicles involve cytoskeleton regulation? Med Hypotheses 2016;91:1–5.
[16] Taieb J, et al. FSH and its second messenger cAMP stimulate the transcription of human anti-Mullerian hormone in cultured granulosa cells. Mol Endocrinol (Baltimore, MD) 2011;25:645–55.
[17] Chiu TT, Rogers MS, Briton-Jones C, Haines C. Effects of myo-inositol on the in-vitro maturation and subsequent development of mouse oocytes. Hum Reprod 2003;18:408–16.
[18] Nestler JE, et al. Insulin stimulates testosterone biosynthesis by human thecal cells from women with polycystic ovary syndrome by activating its own receptor and using inositolglycan mediators as the signal transduction system. J Clin Endocrinol Metab 1998;83:2001–5.
[19] Sacchi S, Marinaro F, Tondelli D, Lui J, Xella S, Marsella T, Tagliasacchi D, Argento C, Tirelli A, Giulini S, La Marca A. Modulation of gonadotrophin induced steroidogenic enzymes in granulosa cells by d-chiroinositol. Reprod Biol Endocrinol 2016;14(1):52. https://doi.org/10.1186/s12958-016-0189-2. 27582109. PMCID: PMC5006365.
[20] Zeleznik AJ, Saxena D, Little-Ihrig L. Protein kinase B is obligatory for follicle-stimulating hormone induced granulosa cell differentiation. Endocrinology 2003;144:3985–94.
[21] Unfer V, Dinicola S, Lagana` AS, Bizzarri M. Altered ovarian inositol ratios may account for pathological steroidogenesis in PCOS. Int J Mol Sci 2020;21(19):7157. https://doi.org/10.3390/ijms21197157. 32998310. PMCID: PMC7582282.
[22] Artini PG, Obino ME, Micelli E, et al. Effect of d-chiro-inositol and alpha-lipoic acid combination on COH outcomes in overweight/obese PCOS women. Gynecol Endocrinol 2020. https://doi.org/10.1080/09513590.2020.1737007.
[23] Lagana` AS, Barbaro L, Pizzo A. Evaluation of ovarian function and metabolic factors in women affected by polycystic ovary syndrome after treatment with D-chiro-inositol. Arch Gynecol Obstet 2015;291(5):1181–6.
[24] Cheang KI, Baillargeon JP, Essah PA, et al. Insulin-stimulated release of D-chiro-inositol-containing inositolphosphoglycan mediator correlates with insulin sensitivity in women with polycystic ovary syndrome. Metabolism 2008;57(10):1390–7.
[25] Lagana` AS, Unfer V. D-chiro-Inositol’s action as aromatase inhibitor: rationale and potential clinical targets. Eur Rev Med Pharmacol Sci 2019;23(24):10575–6.
[26] Franks S. Polycystic ovary syndrome. N Engl J Med 1995;333(13):853–61. https://doi.org/10.1056/NEJM199509283331307. Erratum in: N Engl J Med 1995;333(21):1435 7651477.
[27] Lagana` AS, Rossetti P, Buscema M, et al. Metabolism and ovarian function in PCOS women: a therapeutic approach with inositols. Int J Endocrinol 2016;2016:6306410.
[28] MarchWA, Moore VM,Willson KJ, Phillips DI,NormanRJ, Davies MJ. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Hum Reprod 2010;25(2):544–51. hiips://doi.org/10.1093/humrep/dep399. Epub 2009 Nov 12 19910321.
[29] Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod 2004;19(1):41–7. https://doi.org/10.1093/humrep/deh098. 14688154.
[30] Genazzani AD. Inositol as putative integrative treatment for PCOS. Reprod BioMed Online 2016;33 (6):770–80.
[31] Genazzani AD, Prati A, Marchini F, et al. Differential insulin response to oral glucose tolerance test (OGTT) in overweight/obese polycystic ovary syndrome patients undergoing to myo-inositol (MYO), alpha lipoic acid (ALA), or combination of both. Gynecol Endocrinol 2019;35(12):1088–93.
[32] Carlomagno G, Unfer V, Roseff S. The D-chiro-inositol paradox in the ovary. Fertil Steril 2011;95 (8):2515–6.
[33] Azziz R, Carmina E, Chen Z, et al. Polycystic ovary syndrome. Nat Rev Dis Primers 2016;2:16057.
[34] Unfer V, Carlomagno G, Papaleo E, Vailati S, Candiani M, Baillargeon JP. Hyperinsulinemia alters myoinositol to d-chiroinositol ratio in the follicular fluid of patients with PCOS. Reprod Sci 2014;21:854–8.
[35] Ravanos K, Giovanni M, Pavlidou T, Goudakou M, Prapas N. Can high levels of D-chiro-inositol in follicular fluid exert detrimental effects on blastocyst quality? Eur Rev Med Pharmacol Sci 2017;21 (23):5491–8. https://doi.org/10.26355/eurrev_201712_13940. 29243796.
[36] Facchinetti F, Orru B, Grandi G, Unfer V. Short-term effects of metformin and myo-inositol in women with polycystic ovarian syndrome (PCOS): a meta-analysis of randomized clinical trials. Gynecol Endocrinol Off J Int Soc Gynecol Endocrinol 2019;35:198–206.
[37] Nordio M, Basciani S, Camajani E. The 40:1 myo-inositol/D-chiro-inositol plasma ratio is able to restore ovulation in PCOS patients: comparison with other ratios. Eur Rev Med Pharmacol Sci 2019;23:5512–21.
[38] Unfer V, Porcaro G. Updates on the myo-inositol plus D-chiroinositol combined therapy in polycystic ovary syndrome. Expert Rev Clin Pharmacol 2014;7(5):623–31.
[39] Unfer V, Facchinetti F, Orru` B, Giordani B, Nestler J. Myo-inositol effects in women with PCOS: a meta-analysis of randomized controlled trials. Endocr Connect 2017;6:647–58.
[40] Niethammer B, K€orner C, Schmidmayr M, et al. Non-reproductive effects of anovulation: bone metabolism in the luteal phase of premenopausal women differs between ovulatory and anovulatory cycles. Geburtshilfe Frauenheilkd 2015;75(12):1250–7.
[41] ESHRE Capri Workshop Group. Health and fertility in World Health Organization group 2 anovulatory women. Hum Reprod Update 2012;18(5):586–99. https://doi.org/10.1093/humupd/dms019. Epub 2012 May 19 22611175.
[42] Broekmans FJ, Knauff EA, Valkenburg O, Laven JS, Eijkemans MJ, Fauser BC. PCOS according to the Rotterdam consensus criteria: change in prevalence among WHO-II anovulation and association with metabolic factors. BJOG 2006;113:1210–7.
[43] Shaw ND, Histed SN, Srouji SS, et al. Estrogen negative feedback on gonadotropin secretion: evidence for a direct pituitary effect in women. J Clin Endocrinol Metab 2010;95(4):1955–61.
[44] Lagana` AS, Garzon S, Casarin J, et al. Inositol in polycystic ovary syndrome: restoring fertility through a pathophysiology-based approach. Trends Endocrinol Metab 2018;29(11):768–80.
[45] Iuorno MJ, Jakubowicz DJ, Baillargeon JP, et al. Effects of d-chiroinositol in lean women with the polycystic ovary syndrome. Endocr Pract 2002;8(6):417–23.
[46] Bezerra Espinola MS, Lagana` AS, Bilotta G, Gullo G, Aragona C, Unfer V. D-chiro-inositol induces ovulation in non-polycystic ovary syndrome (PCOS), non-insulin-resistant young women, likely by modulating aromatase expression: a report of 2 cases. Am J Case Rep 2021;22, e932722. https://doi.org/10.12659/AJCR.932722. 34615846. PMCID: PMC8503791.
[47] Gambioli R, Forte G, Aragona C, Bevilacqua A, Bizzarri M, Unfer V. The use of D-chiro-inositol in clinical practice. Eur Rev Med Pharmacol Sci 2021;25(1):438–46. https://doi.org/10.26355/eurrev_202101_24412. 33506934.
[48] La Marca A, Morgante G, Palumbo M, et al. Insulin-lowering treatment reduces aromatase activity in response to follicle-stimulating hormone in women with polycystic ovary syndrome. Fertil Steril 2002;78(6):1234–9.
[49] Bevilacqua A, Dragotto J, Lucarelli M, Di Emidio G, Monastra G, Tatone C. High doses of D-chiroinositol alone induce a PCO-like syndrome and other alterations in mouse ovaries. Int J Mol Sci 2021;22(11):5691. https://doi.org/10.3390/ijms22115691.
[50] Burney RO, Giudice LC. Pathogenesis and pathophysiology of endometriosis. Fertil Steril 2012;98 (3):511–9. https://doi.org/10.1016/j.fertnstert.2012.06.029. Epub 2012 Jul 20 22819144. PMCID:PMC3836682.
[51] Kitawaki J, Noguchi T, Amatsu T, et al. Expression of aromatase cytochrome P450 protein and messenger ribonucleic acid in human endometriotic and adenomyotic tissues but not in normal endometrium. Biol Reprod 1997;57(3):514–9.
[52] Vetvicka V, Lagana` AS, Salmeri FM, et al. Regulation of apoptotic pathways during endometriosis: from the molecular basis to the future perspectives. Arch Gynecol Obstet 2016;294(5):897–904.
[53] Mousa NA, Bedaiwy MA, Casper RF. Aromatase inhibitors in the treatment of severe endometriosis. Obstet Gynecol 2007;109(6):1421–3.
[54] Oner G, Ozcelik B, Ozgun MT, et al. The effects of metformin and letrozole on endometriosis and comparison of the two treatment agents in a rat model. Hum Reprod 2010;25(4):932–7.
[55] Stewart EA, Laughlin-Tommaso SK, Catherino WH, Lalitkumar S, Gupta D, Vollenhoven B. Uterine fibroids. Nat Rev Dis Primers 2016;2:16043. hiips://doi.org/10.1038/nrdp.2016.43. 27335259.
[56] Abushahin F, Goldman KN, Barbieri E, et al. Aromatase inhibition for refractory endometriosisrelated chronic pelvic pain. Fertil Steril 2011;96(4):939–42.
[57] Plewka A, Madej P, Plewka D, Nowaczyk G, Morek M, Bogunia E, Ciupinska-Kajor M, Sieron-Stołtny K. The TRAF2 and TRAF6 expression in myomas and myometrium of women in reproduction and perimenopausal age. Folia Histochem Cytobiol 2010;48(3):407–16. https://doi.org/10.2478/v10042-010-0039-6. 21071347.
[58] Lagana` AS, Vergara D, Favilli A, et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Arch Gynecol Obstet 2017;296(5):855–67.
[59] Lagana` AS, Alonso Pacheco L, Tinelli A, et al. Management of asymptomatic submucous myomas in women of reproductive age: a consensus statement from the global congress on hysteroscopy scientific committee. J Minim Invasive Gynecol 2019;26(3):381–3.
[60] Vitale SG, Sapia F, Rapisarda AMC, et al. Hysteroscopic morcellation of submucous myomas: a systematic review. Biomed Res Int 2017;2017:6848250.
[61] Donnez J, Arriagada P, Marciniak M, Larrey D. Liver safety parameters of ulipristal acetate for the treatment of uterine fibroids: a comprehensive review of the clinical development program. Expert Opin Drug Saf 2018;17(12):1225–32. https://doi.org/10.1080/14740338.2018.1550070. Epub 2018 Nov 29 30460871.
[62] European Medicines Agency. PRAC recommends revoking marketing authorisation of ulipristal acetate for uterine fibroids; 2020. p. 31. [cited 2020 Dec 10]. Available from: https://www.ema.europa.eu/en/news/prac-recommends-revoking-marketing-au-thorisation-ulipristal-acetate-uterinefibroids.
[63] Al-Hendy A, Diamond MP, El-Sohemy A, Halder SK. 1,25-dihydroxyvitamin D3 regulates expression of sex steroid receptors in human uterine fibroid cells. J Clin Endocrinol Metab 2015;100(4): E572–82. https://doi.org/10.1210/jc.2014-4011. Epub 2015 Jan 27 25625804. PMCID: PMC4399292.
[64] Bulun SE, Simpson ER, Word RA. Expression of the CYP19 gene and its product aromatase cytochrome P450 in human uterine leiomyoma tissues and cells in culture. J Clin Endocrinol Metab 1994;78(3):736–43.
[65] Shozu M, Sumitani H, Segawa T, et al. Overexpression of aromatase P450 in leiomyoma tissue is driven primarily through promoter I.4 of the aromatase P450 gene (CYP19). J Clin Endocrinol Metab 2002;87(6):2540–8.
[66] Sinai TV. Medical therapy for fibroids: an overview. Best Pract Res Clin Obstet Gynaecol 2018;46:48–56.
[67] Kurman RJ, Kaminski PF, Norris HJ. The behavior of endometrial hyperplasia. A long-term study of “untreated” hyperplasia in 170 patients. Cancer 1985;56(2):403–12. https://doi.org/10.1002/1097-0142(19850715)56:2<403::aid-cncr2820560233>3.0.co;2-x. 4005805.
[68] Armstrong AJ, Hurd WW, Elguero S, Barker NM, Zanotti KM. Diagnosis and management of endometrial hyperplasia. J Minim Invasive Gynecol 2012;19(5):562–71. https://doi.org/10.1016/j.jmig.2012.05.009. Epub 2012 Aug 3 22863972.
[69] Gao C, Wang Y, Tian W, Zhu Y, Xue F. The therapeutic significance of aromatase inhibitors in endometrial carcinoma. Gynecol Oncol 2014;134(1):190–5. https://doi.org/10.1016/j.ygyno.2014.04.060. Epub 2014 May 5 24811574.
[70] Zhao PL, Zhang QF, Yan LY, Huang S, Chen Y, Qiao J. Functional investigation on aromatase in endometrial hyperplasia in polycystic ovary syndrome cases. Asian Pac J Cancer Prev 2014;15 (20):8975–9. https://doi.org/10.7314/apjcp.2014.15.20.8975. 25374239.
[71] Agorastos T, Vaitsi V, Pantazis K, Efstathiadis E, Vavilis D, Bontis JN. Aromatase inhibitor anastrozole for treating endometrial hyperplasia in obese postmenopausal women. Eur J Obstet Gynecol Reprod Biol 2005;118(2):239–40. https://doi.org/10.1016/j.ejogrb.2004.07.002. 15653211.
[72] Huang B, Warner M, Gustafsson JA° . Estrogen receptors in breast carcinogenesis and endocrine therapy. Mol Cell Endocrinol 2015;418(Pt 3):240–4. https://doi.org/10.1016/j.mce.2014.11.015. Epub 2014 Nov 26 25433206.
[73] Trabert B, Coburn SB, Falk RT, Manson JE, Brinton LA, Gass ML, Kuller LH, Rohan TE, Pfeiffer RM, Qi L, Stefanick ML, Wentzensen N, Anderson GL, Xu X. Circulating estrogens and postmenopausal ovarian and endometrial cancer risk among current hormone users in the Women’s HealthInitiative Observational Study. Cancer Causes Control 2019;30(11):1201–11. https://doi.org/10.1007/s10552-019-01233-8. Epub 2019 Sep 21 31542834. PMCID: PMC6785392.
[74] Tian W, Teng F, Zhao J, Gao J, Gao C, Sun D, Liu G, Zhang Y, Yu S, Zhang W, Wang Y, Xue F. Estrogen and insulin synergistically promote type 1 endometrial cancer progression. Cancer Biol Ther2017;18(12):1000–10. https://doi.org/10.1080/15384047.2017.1394547. Epub 2017 Nov 27 29172956. PMCID: PMC5718804.
[75] Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015;386 (10001):1341–52. https://doi.org/10.1016/S0140-6736(15)61074-1. Epub 2015 Jul 23 26211827.
[76] McHenry J, Carrier N, Hull E, Kabbaj M. Sex differences in anxiety and depression: role of testosterone. Front Neuroendocrinol 2014;35(1):42–57. https://doi.org/10.1016/j.yfrne.2013.09.001.
[77] Bekker MH, van Mens-Verhulst J. Anxiety disorders: sex differences in prevalence, degree, and background, but gender-neutral treatment. Gend Med 2007;4(Suppl B):S178–93.
[78] Seedat S, Scott KM, Angermeyer MC, Berglund P, Bromet EJ, Brugha TS, Demyttenaere K, de Girolamo G, Haro JM, Jin R, Karam EG, Kovess-Masfety V, Levinson D, Medina Mora ME, Ono Y, Ormel J, Pennell BE, Posada-Villa J, Sampson NA, Williams D, Kessler RC. Cross-national associations between gender and mental disorders in the World Health Organization world mental health surveys. Arch Gen Psychiatry 2009;66(7):785–95. https://doi.org/10.1001/archgenpsychiatry.2009.36. 19581570. PMCID: PMC2810067.
[79] Douma SL, Husband C, O’Donnell ME, Barwin BN, Woodend AK. Estrogen-related mood disorders: reproductive life cycle factors. ANS Adv Nurs Sci 2005;28(4):364–75. https://doi.org/10.1097/00012272-200510000-00008. 16292022.
[80] Zarrouf FA, Artz S, Griffith J, Sirbu C, Kommor M. Testosterone and depression: systematic review and meta-analysis. J Psychiatr Pract 2009;15(4):289–305. https://doi.org/10.1097/01.pra.0000358315.88931.fc. 19625884.
[81] Davis SR, Tran J. Testosterone influences libido and well being in women. Trends Endocrinol Metab 2001;12(1):33–7. https://doi.org/10.1016/s1043-2760(00)00333-7. 11137039.
[82] Davis S. Androgen replacement in women: a commentary. J Clin Endocrinol Metab 1999;84 (6):1886–91. https://doi.org/10.1210/jcem.84.6.5802. 10372681.
[83] Sherwin BB. Affective changes with estrogen and androgen replacement therapy in surgically menopausal women. J Affect Disord 1988;14(2):177–87. https://doi.org/10.1016/0165-0327(88)90061-4. 2966832.
[84] Brincat M, Magos A, Studd JW, Cardozo LD, O’Dowd T, Wardle PJ, Cooper D. Subcutaneous hormone implants for the control of climacteric symptoms. A prospective study. Lancet 1984;1
(8367):16–8. https://doi.org/10.1016/s0140-6736(84)90183-1. 6140343.
[85] Montgomery JC, Appleby L, Brincat M, Versi E, Tapp A, Fenwick PB, Studd JW. Effect of oestrogen and testosterone implants on psychological disorders in the climacteric. Lancet 1987;1(8528):297–9. https://doi.org/10.1016/s0140-6736(87)92026-5. 2880114.
[86] Abramov Y, Elchalal U, Schenker JG. Severe OHSS: an ’epidemic’ of severe OHSS: a price we have to pay? Hum Reprod 1999;14(9):2181–3. https://doi.org/10.1093/humrep/14.9.2181. 10469676.
[87] Papanikolaou EG, Humaidan P, Polyzos N, Kalantaridou S, Kol S, Benadiva C, Tournaye H, Tarlatzis B. New algorithm for OHSS prevention. Reprod Biol Endocrinol 2011;9:147. https://doi.org/ 10.1186/1477-7827-9-147. 22054506. PMCID: PMC3230134.
[88] De Geyter C, Fehr P, Moffat R, Gruber IM, von Wolff M. Twenty years’ experience with the Swiss data registry for assisted reproductive medicine: outcomes, key trends and recommendations for improved practice. Swiss Med Wkly 2015;145, w14087. https://doi.org/10.4414/smw.2015.14087. 25668217.
[89] Blumenfeld Z. The ovarian hyperstimulation syndrome. Vitam Horm 2018;107:423–51. https://doi.org/10.1016/bs.vh.2018.01.018. Epub 2018 Feb 23 29544639.
[90] Abramov Y, Barak V, Nisman B, Schenker JG. Vascular endothelial growth factor plasma levels correlate to the clinical picture in severe ovarian hyperstimulation syndrome. Fertil Steril 1997;67(2):261–5. https://doi.org/10.1016/S0015-0282(97)81908-5. 9022600.
[91] Jellad S, Haj Hassine A, Basly M, Mrabet A, Chibani M, Rachdi R. Vascular endothelial growth factor antagonist reduces the early onset and the severity of ovarian hyperstimulation syndrome. J Gynecol Obstet Hum Reprod 2017;46(1):87–91. https://doi.org/10.1016/j.jgyn.2016.04.002. Epub 2016 May 27 28403961.
[92] Aboulghar M. Prediction of ovarian hyperstimulation syndrome (OHSS). Estradiol level has an important role in the prediction of OHSS. Hum Reprod 2003;18(6):1140–1. https://doi.org/10.1093/humrep/deg208. 12773437.
[93] Practice Committee of the American Society for Reproductive Medicine. Prevention and treatment of moderate and severe ovarian hyperstimulation syndrome: a guideline. Fertil Steril 2016;106(7):1634–47. https://doi.org/10.1016/j.fertnstert.2016.08.048. Epub 2016 Sep 24 27678032.
[94] Nelson SM. Prevention and management of ovarian hyperstimulation syndrome. Thromb Res 2017;151(Suppl 1):S61–4. https://doi.org/10.1016/S0049-3848(17)30070-1. 28262238.
[95] Mai Q, Hu X, Yang G, Luo Y, Huang K, Yuan Y, Zhou C. Effect of letrozole on moderate and severe early-onset ovarian hyperstimulation syndrome in high-risk women: a prospective randomized trial. Am J Obstet Gynecol 2017;216(1):42.e1–42.e10. https://doi.org/10.1016/j.ajog.2016.08.018. Epub 2016 Aug 20 27555316.
[96] Tshzmachyan R, Hambartsoumian E. The role of Letrozole (LE) in controlled ovarian stimulation (COS) in patients at high risk to develop ovarian hyper stimulation syndrome (OHSS). A prospective randomized controlled pilot study. J Gynecol Obstet Hum Reprod 2019;101643. https://doi.org/10.1016/j.jogoh.2019.101643.
[97] Khattab S, Fotouh IA, Mohesn IA, Metwally M, Moaz M. Use of metformin for prevention of ovarian hyperstimulation syndrome: a novel approach. Reprod BioMed Online 2006;13(2):194–7. https://doi.org/10.1016/s1472-6483(10)60614-1. 16895631.
[98] Dupont J, Scaramuzzi RJ. Insulin signalling and glucose transport in the ovary and ovarian function during the ovarian cycle. Biochem J 2016;473:1483–501.
[99] Ciotta L, Stracquadanio M, Pagano I, Carbonaro A, Palumbo M, Gulino F. Effects of myo-inositol supplementation on oocyte’s quality in PCOS patients: a double blind trial. Eur Rev Med Pharmacol Sci 2011;15(5):509–14. 21744744.
[100] Papaleo E, Unfer V, Baillargeon JP, Fusi F, Occhi F, De Santis L. Myo-inositol may improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial. Fertil Steril 2009;91(5):1750–4. https://doi.org/10.1016/j.fertnstert.2008.01.088. Epub 2008 May 7 18462730.
[101] Unfer V, Carlomagno G, Rizzo P, Raffone E, Roseff S. Myo-inositol rather than D-chiro-inositol is able to improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial. Eur Rev Med Pharmacol Sci 2011;15(4):452–7. 21608442.
[102] Unfer V, Carlomagno G, Dante G, Facchinetti F. Effects of myo-inositol in women with PCOS: a systematic review of randomized controlled trials. Gynecol Endocrinol 2012;28(7):509–15. https:// doi.org/10.3109/09513590.2011.650660. Epub 2012 Feb 1 22296306.
Articoli in evidenza
PCOS, il fenotipo D sotto la lente di ingrandimento
La sindrome dell'ovaio policistico (PCOS) è considerata il disturbo endocrinologico più comune tra le donne in età riproduttiva. Le pazienti con PCOS soffrono di numerosi problemi di salute, tra cui...
PCOS: se fosse necessario riconsiderare eziologia, diagnosi e trattamenti?
La sindrome dell’ovaio policistico (PCOS) rappresenta una delle patologie più comuni nelle donne in età fertile. L’eterogeneità della PCOS, la diversità delle sue manifestazioni cliniche,...
Prof. Andrea Tinelli: sintomi, cause e trattamenti dei fibromi uterini
Il Prof. Andrea Tinelli, direttore dell’U.O.C. Ginecologia ed Ostetricia all’Ospedale Scorrano di Lecce, è intervenuto ai microfoni di “La Casa della Salute” su RTV San Marino per parlare di fibromi...